Verband tussen nanostructuur en eigenschappen
ORIENTEREN
Hoe kun je onrechtstreeks afmetingen van nanodeeltjes bepalen?
VOORBEREIDEN
Materialen en producten
- 1 kookplaat
- 2 bekers 50 ml
- 1 bekerglas 200 ml
- 2 bekers 500 ml
- 800 ml magere melk
- 4 eetlepels witte azijn
- Thermometer
- 1 spatel
- Latex handschoenen
- Veiligheidsbril
- Vergrootglas
UITVOEREN
1.De nodige materialen:
- Een beker melk
- Een bekerglas warme melk (60°C)
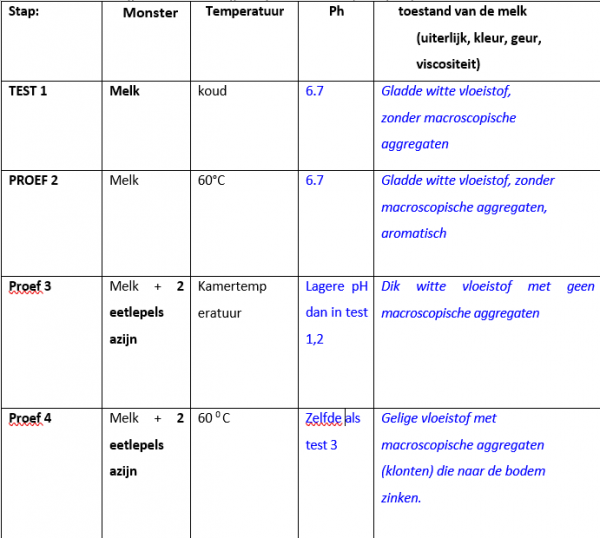
2. Met behulp van een pH-papier (dat controleert op de zuurgraad) registreer je de zuurgraad (pH) van magere melk.
3. Neem een schoon bekerglas en voeg nog een monster van 400 ml koude melk toe. Leg het bekerglas met melk op een kookplaat, zet de kookplaat aan en verwarm de melk tot ongeveer 60°C. Wanneer de melk warm is, controleer de zuurgraad met een nieuw stuk pH-papier en noteer het resultaat . Observeer de melk en roer het met een lepel en noteer de manier waarop het eruit ziet, ruikt en voelt .
4.Voeg aan de koele melk 2 eetlepels witte azijn (een zure oplossing) toe en roer goed terwijl je dit doet. Wat gebeurt er (kijken, ruiken, voelen)? Noteer waarnemingen.
5.Herhaal de test en voeg dezelfde hoeveelheid azijn (2 eetlepels) toe, maar aan de warme melk. Roer en laat een minuut of twee staan. Noteer de waarnemingen
WAARNEMEN
Na een korte tijd ontstaat volgende fase
REFLECTEREN
Wanneer de melk koud is, verstoort de toevoeging van zuur de micellen tot op zekere hoogte, maar de hydrofobe interacties behouden enige stabiliteit van de caseïnemicellen, zodat ze niet neerslaan en we een dikke vloeistof krijgen. Wanneer de melk warm is, zijn er twee factoren die samen de stabiliteit van de caseïnemicellen verstoren, de zuurgraad (die leidt tot de afgifte van calciumfosfaat) en de hoge temperatuur, die hydrofobe interacties sterker maken. Die twee effecten samen verstoren de stabiliteit van de caseïnemicellen tot het punt dat ze neerslaan.
De micellen bestaan uit een wirwar van caseïnemoleculen. Er zijn meer dan één soort caseïnemolecuul is . Alle soorten caseïnemoleculen zijn lang en dun en bezitten allemaal een hydrofoob gebied (d.w.z. afgestoten door water) en een gebied met een effectieve elektrostatische lading. De verschillende caseïnesoorten verschillen in de plaatsing van deze gebieden. Als gevolg van deze regio’s bezitten alle caseïnes, behalve één, k-caseïne genaamd, het vermogen om te binden aan een calciumion, Ca2 +
Er kunnen twee soorten koppelingen zijn tussen caseïne in de caseïnemicellen:
- De eerste koppeling is hydrofoob, waarbij twee of meer hydrofobe gebieden van verschillende moleculen (α-caseïne en β caseïne) een cluster vormen (vergelijkbaar met olievormende druppels in water). Deze zijn in figuur 2 aangegeven als een rechthoekige balk . Deze schakels zijn gevoelig voor temperatuur.
- De tweede koppeling is van hydrofiele geladen gebieden die binden aan kleine nanokristallen die calciumfosfaatnanoclusters of colloïdale calciumfosfaatnanoclusters worden genoemd. Deze zijn gevoelig voor zuurgraad (pH).
De k-caseïnes kunnen zich niet verbinden met de calciumnanoclusters; daarom interageren ze alleen met de andere moleculen door hydrofobe interacties, en daarom kunnen de micellen niet verder groeien dan de k-caseïnes, die daarom fungeren als een buitenste laag in de micel. De rol van k-caseïne is om de caseïnemicellen te stabiliseren, waardoor overmatige groei en micellaire aggregatie (waarbij de micellen aan elkaar kleven) wordt voorkomen, wat anders zou leiden tot neerslag (de micellen zinken naar de bodem).
Het verlagen van de pH tot 4,6 door toevoeging van een zuur induceert dissociatie van de caseïnemicellen. De reden hiervoor is dat calciummicellen alleen bestaan vanwege de aanwezigheid van calciumfosfaat. Daarom veroorzaakt de ontbinding ervan noodzakelijkerwijs veranderingen in de stabiliteit van de micellen. Als een zuur (een protondonor) aan melk wordt toegevoegd, zijn de geladen gebieden niet langer in staat om elektrostatisch te interageren met calciumfosfaatnanoclusters en deze komen vrij uit de micellen. Opgemerkt moet worden dat dit er niet noodzakelijkerwijs voor zorgt dat de caseïne zich losmaakt van de micellen. Bij temperaturen onder de 25°C treedt een toenemende dissociatie op, maar verder blijven de caseïnes in de micellen achter. De reden ligt in het feit dat de stabiliteit van caseïnemicellen niet uitsluitend verband houdt met elektrostatische interactie, maar ook met hydrofobe interacties. Deze laatste zijn extreem temperatuurafhankelijk: hydrofobe interacties zijn sterker bij hogere temperaturen. Daarom handhaven hydrofobe interacties de stabiliteit van caseïnemicellen in koude melk, zelfs wanneer de pH is verlaagd. Aan de andere kant, als verzuring optreedt nadat melk is opgewarmd (tot ongeveer 60 ° C), worden micellen gedissocieerd (calciumfosfaat komt vrij uit de micel)






