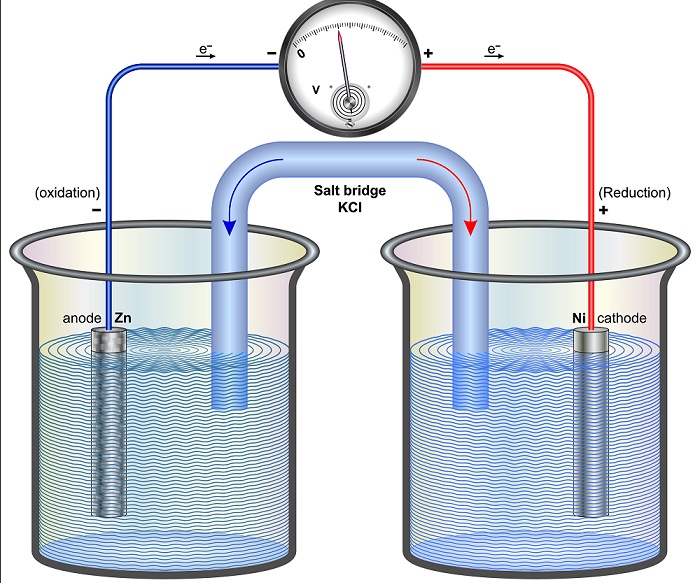
Sterkte reductor en oxidator
Definities
Experimenten
Filmfragmenten
Lesvideo's youtube
Eigen lesvideo's
- Sterkte van oxidatoren en reductoren: algemeen – voorbeeld – conclusies – stappenplan
Oefeningen lesvideo's
- Voorspel of de reactie Cu + H2O opgaat
- Voorspel of de reactie KMnO4 + NaBr opgaat
- Voorspel of de reactie HCl + Fe opgaat
- Geef aan of de redoxreactie optreedt tussen aluminium en zoutzuur
- Geef aan of de redoxreactie optreedt tussen water en aluminiumfluoride
- Geef aan of er een redoxreactie optreedt tussen zink (s) en water
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd: Ijzer(III)acetaat-oplossing en Ni
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd: Chloor en een zwaveldioxide-oplossing
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd.Een oplossing van KBr en I2
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd:Tin(IV)bromide-oplossing en een overmaat aluminium
- Geef de reactievergelijking, indien de reactie plaatsvindt, wanneer de volgende stoffen aan elkaar worden toegevoegd. Een waterstofperoxide-oplossing en een aangezuurde kaliumjodide-oplossing
- Voorspel het verloop van de volgende reacties. Noteer eveneens de deeltjes van de mogelijke reactieproducten:
- Sn + H3O+ –> Sn2+ + H2 + H2O
- Cu + Br2 –> Cu2+ + Br–
- H2S + Fe3+ –> S + Fe2+
- I–+ Cr2O72- –> I2 + Cr3+
- Mg + Br2 –> Mg2+ + 2 Br–
- Sn2++ Hg2+ –> Sn4+ + Hg+
- KBr + H2SO4 –> Br2 + SO2
- Mn2+ + I2 –> MnO2 + I–
- Zal de reactie 2 Br– + S + 2 H+ –> Br2 + H2S spontaan doorgaan?
- Wat gebeurt er als we NO3– en Mn2+ samenvoegen ?
- Kan Mn2+ geoxideerd worden door H2O2 ?
Halfreacties opstellen
- Stel de halfreacties op van de reactie van aluminium met dichloor.
- Geef de halfreactie van de omzetting van het dichromaation Cr2O72- tot Cr3+ in een zuur milieu
- Het permanganaation MnO4– wordt omgezet in neutraal milieu in mangaan(IV)oxide, MnO2. Geef de halfreactie.
Richting redoxreactie
Cl2 + Mn2+ <–> Cl– + MnO4– in zuur milieu
Werking batterij