Polariteit en elektronegativiteit
Onderzoeksvraag
Wanneer is een moleculen polair of apolair?
Onderzoek
Start de computer op en ga naar onderstaande website. https://phet.colorado.edu/nl/simulation/molecule-polarity
Jullie bekomen deze pagina.
Download de simulatie. Als je dit gedaan hebt, opent in enkele ogenblikken via JAVA de simulatie waar je mee moeten werken.
Je krijgt het volgende beeld te zien.
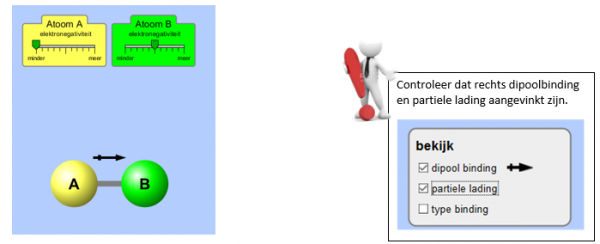
Zorg ervoor dat Atoom A een grotere elektro-negativiteit heeft dan Atoom B.
Schakel dan het elektrisch veld aan.
- Wat gebeurde er met de molecule toen het elektrisch veld was aangeschakeld?
- Kan je dit verklaren? Tip: hou rekening met de partiele ladingen.
Ga nu bovenaan naar drie atomen. Je krijgt het volgende beeld te zien.
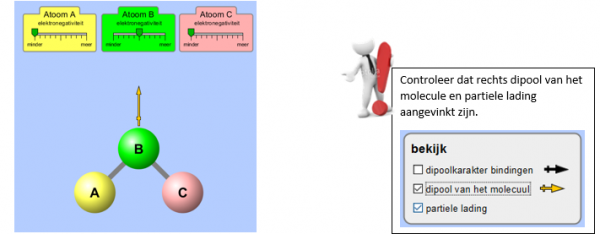
Zorg ervoor dat atoom B de grootste elektronegativiteit heeft.
Schakel dan het elektrisch veld aan.
- Wat gebeurde er met de molecule toen het elektrisch veld was aangeschakeld?
- Kan je dit verklaren? Tip: hou opnieuw rekening met de partiële ladingen.
Ga nu bovenaan naar echte moleculen. Je krijgt het volgende beeld te zien.
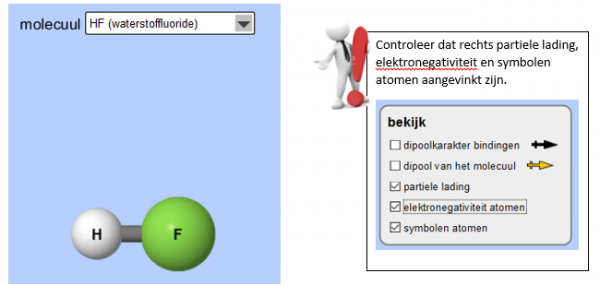
- Waarom heeft het atoom Fluor een negatieve partiele lading?
Deze molecule heeft een ladingsverschil. Dat wil zeggen dat de molecule een positieve kant en een negatieve kant heeft.
- De molecule waterstoffluoride is asymmetrisch/symmetrisch
Waterstoffluoride is polair
Zorg nu dat je de molecule methaan ziet. Je krijgt het volgende beeld te zien.
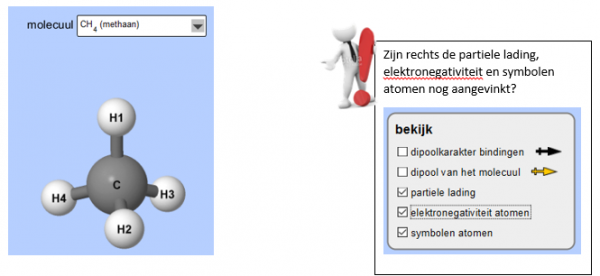
- Welk atoom heeft de grootste negatieve partiële lading?
Deze molecule bevat geen positieve kant en een negatieve kant, maar bevat een negatief centrum. Deze molecule heeft dus geen ladingsverschil.
- De molecule methaan is asymmetrisch/symmetrisch.
Methaan is apolair.
Besluit
We spreken van een polaire molecule indien:
- de molecule asymmetrisch is.
- de molecule een ladingsverschil bevat.
We spreken van een apolaire molecule indien:
- de molecule symmetrisch is.
- de molecule geen ladingsverschil bevat.
Extra oefening
Zoek de volgende molecule op en vul onderstaande tabel volledig in.