pHet reactanten, producten en resten
Inleiding:
Wanneer we iets bakken / koken, gebruiken we een specifieke hoeveelheid van elk ingrediënt. Stel je voor dat je een reeks koeken gemaakt hebt en veel te veel eieren gebruikt hebt, of te weinig suiker. BAH! In de chemie werken de reacties met zeer specifieke recepten. De studie van deze recepten is stoichiometrie. Wanneer de reactanten in de juiste hoeveelheden aanwezig zijn, maakt de reactie producten. We gaan kijken naar wat er gebeurt als er meer of minder van een aantal van de aanwezige reactanten zijn.
Deel 1: Sandwiches maken:

- Een broodje kaas heeft 2 sneetjes brood nodig en 1 plak kaas. Als er precies twee keer zoveel sneetjes brood als kaas zijn, dan zijn er geen overblijfselen. Wat gebeurt er als je twee plakjes brood hebt met twee plakjes kaas? Je hebt een plak kaas over!
- Gebruik de simulatie om te spelen met deze synthesereactie met twee
reactanten. Neem wat tijd en Maak uzelf vertrouwd met de simulatieknoppen - Wijzig onder aan het scherm de coëfficiënten van de reactanten in 2:1.

Merk op dat er nu een broodje is zonder restjes!
Voltooi situaties B tot en met D. A is voor jou gedaan als een voorbeeld.
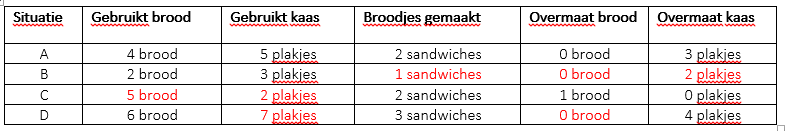
Kijk naar situatie A. De kaas zou in dit geval overmaat zijn. De andere reactant (brood) heeft geen restjes. Het brood is in dit geval het limiterend reagens.
Bepaal in de situaties B, C en D het limiterend reagens:
B: ____0_________ C: ______1_______ D: _____0________
Deel 2: echte chemische reacties1.
Selecteer “Moleculen” naar de onderkant van uw scherm. We kunnen nu werken met echte chemische reacties, een die een zeer leuke BOOM creëert!
Wat is de kleinste molecuulverhouding voor de reactie van waterstof en zuurstof om water te produceren? Dat is, balanceer de volgende vergelijking:
_2_H2 + __O2 –> _2_H2O
Vul onderstaande tabel in terwijl je water H2O maakt uit waterstof H2 en zuurstof O2:
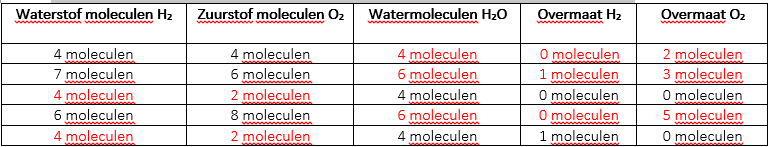
Stoppen voor controlepunt: handtekening van de leraar voor deze pagina: ____________________
Selecteer naar de top, selecteer . Ammoniak is een zeer belangrijke chemische stof in de industrie en de landbouw.
Ammoniak is een zeer belangrijke chemische stof in de industrie en de landbouw.
Vul de onderstaande tabel in:

Selecteer naar boven  , wat twee producten oplevert, water en koolstofdioxide CO2.
, wat twee producten oplevert, water en koolstofdioxide CO2.
Balanceer de vergelijking voor de verbranding van methaan: __CH4 + _2__O2 –> __CO2 + _2_H2O
Vul de onderstaande tabel in:
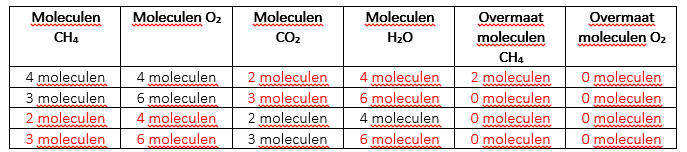
Stoppen voor controlepunt: handtekening van de leraar voor deze pagina: ____________________
Deel 3: Het beste gedeelte:
Ga naar het spel-sectie. Om dit te doen klik je op een knop genaamd “spel” dat heeft een smiley, die zich onderaan het scherm bevindt.
Er zijn drie niveaus. Elk niveau heeft 5 uitdagingen. Wanneer je denkt dat je het aantal moleculen nodig hebt, klik op de knop “Controleren”. Jij krijgt punten als de vergelijking correct is. Je krijgt maar twee pogingen.Voltooi alle 5 pogingen. Wanneer je het laatste scherm bereikt (zie afbeelding rechts), noteer je score en toon je docent je score voordat je verdergaat … anders moet je het opnieuw doen! Nadat je niveau 1 hebt voltooid, ga je verder naar niveau 2. Probeer vervolgens niveau 3.






