pHet molaire concentratie2
APP: https://phet.colorado.edu/sims/html/concentration/latest/concentration_nl.html
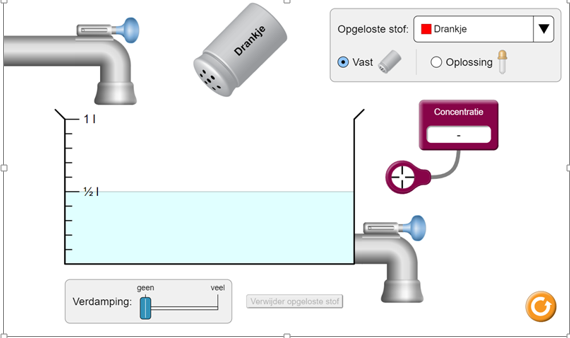
Op deze website kunnen jullie verschillende oplossingen maken met allerlei opgeloste stoffen.
In het midden van jullie scherm staat er een maatbeker met een volume van een liter.
Links boven staat er een waterkraan om extra water bij te voegen in de maatbeker. Rechts onder staat er nog een andere kraan, met deze kraan kan je oplossing uit je maatbeker laten lopen.
Onder de maatbeker staan er nog twee verschillende knoppen. Met de linker knop kan je het oplosmiddel laten verdampen en met de rechter knop kan je de opgeloste stof in een klink verwijderen uit de maatbeker.
Rechts boven de maatbeker heb je een klein menu waar je de opgeloste stof kan uitkiezen uit een lijst van verschillende stoffen. Hier heb je ook de mogelijkheid om te kiezen tussen een vaste of vloeibare vorm van de opgeloste stof.
Als laatste hebben jullie onder het menu van de opgeloste stof een concentratiemeter. Als je deze meter op de maatbeker en in de oplossing plaats vertelt hij je de molaire concentratie van de oplossing.
→ Probeer zelf iedere oefening uit om te dan zelf te kijken wat het juiste antwoord is.
Welke acties zullen de concentratie van de oplossing doen stijgen?
- Meer Co(NO3)2 toevoegen.
2. Water verdampen.
3. De oplossing deels weggieten. - Optie 1
B. Optie 1 en 2
C. Optie 2 en 3
D. Optie 1 en 3
E. Optie 1, 2 en 3
Welke acties zullen de hoeveelheid mol in de oplossing veranderen?
- Meer water toevoegen.
2. Water verdampen.
3. De oplossing deels weggieten. - Optie 1
B. Optie 2
C. Optie 3
D. Optie 1 en 2
E. Optie 2 en 3
Wat zal er gebeuren met de concentratie en het aantal mol wanneer we water toevoegen?
- Concentratie stijgt en het aantal mol daalt.
B. Concentratie stijgt en het aantal mol stijgt.
C. Concentratie en het aantal mol blijven gelijk.
D. Concentratie daalt en het aantal mol daalt.
E. Concentratie daalt en het aantal mol blijft gelijk.
Wat is de hoeveelheid mol in de oplossing?
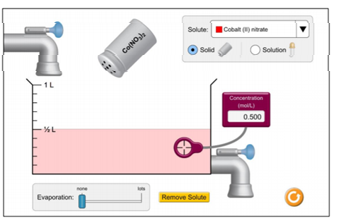
- 0,05 mol
B. 0,50 mol
C. 1,00 mol
D. 1,50 mol
E. Geen van bovenstaande van de bovenstaande opties.
Je start met een 0,400 mol/l KMnO4 oplossing van 200 ml. Hoeveel is de concentratie van die oplossing wanneer je 600 ml water extra toevoegt?

- 0,08 mol/l
B. 0,10 mol/l
C. 0,20 mol/l
D. 0,40 mol/l
E. 1,60 mol/l
Je start met een 5,00 mol/l NiCl2 oplossing van 0,1 l. Je wilt de oplossing verdunnen tot een concentratie van 0,625 mol/l NiCl2. Hoever moet je de oplossing bijvullen om die concentratie te bekomen?
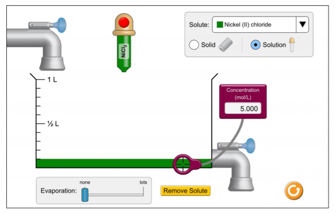
- Bijvullen tot 200 ml.
B. Bijvullen tot 400 ml.
C. Bijvullen tot 600 ml.
D. Bijvullen tot 800 ml.
E. Bijvullen tot 1 l.
Je hebt een 1,0 mol/l NaCl oplossing gemaakt in het labo. Wat is de concentratie van de chloride- ionen in deze oplossing?
- 0,50 mol/l
B. 1,0 mol/l
C. 1,5 mol/l
D. 2,0 mol/l






