pHet Interacties tussen atomen
APP: https://phet.colorado.edu/sims/html/atomic-interactions/latest/atomic-interactions_nl.html
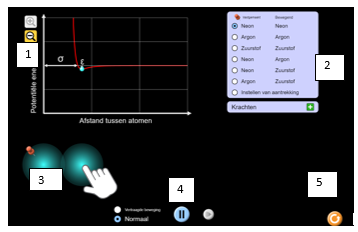
1: inzoomen of uitzoomen
2: de verschillende elementen die je kan testen
3: 1 element is vastgepind de andere kan je bewegen door er met de muis op te klikken.
4: je kan de animatie op pauze zetten of terugspoelen
5: je kan helemaal opnieuw beginnen
Als je op het groene plusje klikt kan je verschillende krachten aanzetten.
Atomic Interactions
De simulatie Atomic Interactions laat de potentiële energie samen met bindingsformatie zien. Bindingen en bindingsenergie zijn onderwerpen voorgesteld voor intermoleculaire krachten.
Gebruik de simulatie om te laten zien hoe de potentiële energie (PE) verandert tijdens het maken van een binding. Laat atomen eerst zien als ze ver uiteen staan, daarna door de aantrekking zal de PE dalen. Leg de nadruk dat de potentiële energie afneemt als de atomen aangetrokken zijn tot elkaar.
Verbind chemische termen met wat we al hebben geleerd over bindingen. Een grote enthalpie komt overeen met een sterke binding, deze gaat gepaard met een lage potentiële energie.
Wat er vaak fout gedacht wordt is dat een sterke binding overeen komt met veel potentiële energie en dat deze energie vrijkomt wanneer de binding breekt.
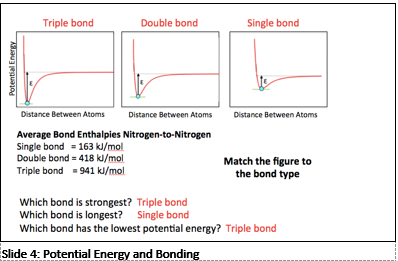
Opdracht
Zijn de aangegeven elementen metalen – niet-metalen?
Verklaar:
Waarom stoten alle elementen elkaar af buiten zuurstof – zuurstof?
Wat voor binding is zuurstof – zuurstof?
Waarom trillen de 2 zuurstof atomen als ze in contact komen met elkaar?






