Molariteit van zouten in water
Introductie
Open de volgende link: Molariteit zouten in water (cmp). Je verkrijgt de volgende simulatie.
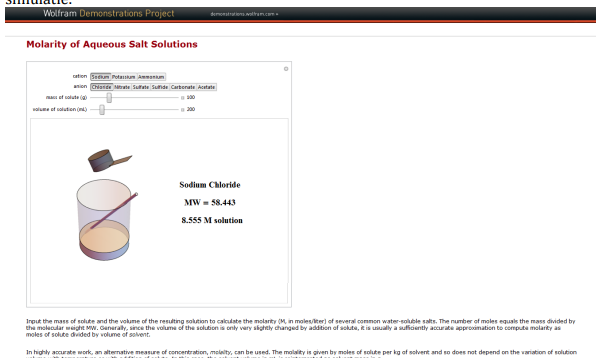
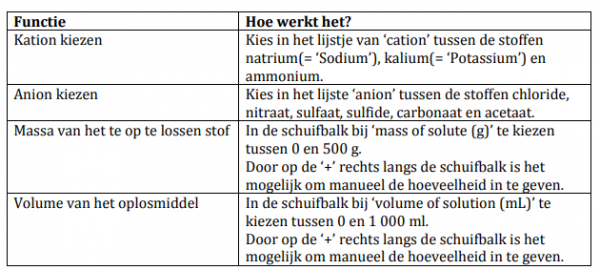
Het is de bedoeling dat je onderstaande opdrachten uitvoert met de simulatie. Hier is een korte uitleg over de verschillende functies.
Langs de maatbeker kan je de molariteit van het zout in water aflezen bij “… M solution”.
Je kan erboven ook de molaire massa van het zout terugvinden bij “MW=…” .
Opdrachten
Voer de onderstaande opdrachten nauwkeurig uit.
Opdracht 1
1. Los 100g NaCl op in 100 ml oplossing.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
2. Los 200g NaCl op in 100 ml oplossing.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
3. Los 500g NaCl op in 100 ml oplossing.
Wat is de molariteit van het zout inde oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
BESLUIT: (schrap wat niet past)
We zien dat de molariteit van het zout in de oplossing steeds groter/kleiner wordt naarmate de massa van het zout groter wordt.
De molaire massa van het zout in het water is NIET afhankelijk van het volume van de oplossing.
Opdracht 2
1. Los 200g K2CO3 op in 100 ml oplossing.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
2. Los 200g K2CO3 op in 500 ml oplossing.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
3. Los 200g K2CO3 op in 1 l oplosmiddel.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
BESLUIT: (schrap wat niet past)
We zien dat de molariteit van het zout in de oplossing steeds groter/kleiner wordt
naarmate het volume van het water groter wordt.
De molaire massa van het zout is NIET afhankelijk van het volume oplosmiddel.
Opdracht 3
1. Los 350g (NH4)2SO4 op in 750 ml oplosmiddel.
Wat is de molariteit van het zout in de oplossing?
……………………………………………………………………………………………………………………………………..
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
2. Los 350g Na2CO3 op in 750 ml oplosmiddel.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
3. Los 350 g KNO3 op in 750 ml oplosmiddel.
Wat is de molariteit van het zout in de oplossing?
………………………………………………………………………………………………………………
Wat is de molaire massa van het zout in de oplossing?
………………………………………………………………………………………………………………
BESLUIT: (schrap wat niet past)
We zien dat de molariteit van het zout in de oplossing afhankelijk/onafhankelijk is van het zout.
De molaire massa van het zout is afhankelijk van de atomen waaruit het zout bestaat. Je kan deze terugvinden in het periodiek systeem.
Besluit
(schrap wat niet past+vul in)
De molariteit van het zout in de oplossing is recht evenredig / omgekeerd evenredig met de stofhoeveelheid van het zout.
De molariteit van het zout in de oplossing is recht evenredig / omgekeerd evenredig met het volume oplosmiddel.
Hieruit kunnen we de volgende formule afleiden: We kunnen de stofhoeveelheid van het zout berekenen aan de hand van de massa en de molaire massa van het zout.
Hiervoor kennen we de volgende formule:
Uit deze formule kunnen we afleiden dat de stofhoeveelheid van het zout recht evenredig/ omgekeerd evenredig is met de massa van het zout. De stofhoeveelheid van het zout is recht evenredig / omgekeerd evenredig met de molaire massa van het zout.
Oefeningen
Los de volgende oefeningen op. Controleer daarna met de simulatie.
1. Hoe groot is de molariteit van K2S wanneer we hiervan 350g oplossen in 350 ml oplosmiddel?
…………………………………………………………………………………………………………………………
2. Hoe groot is de molariteit van 150g CH3CO2K in 100 ml oplossmiddel?
…………………………………………………………………………………………………………………………
3. Hoe groot is de molariteit van 250g NaCl in 600 ml oplosmiddel?
………………………………………………………………………………………………………






