Koolstofmonoxide
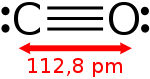
| Formule | CO koolmonoxide, kooldamp |
| Familie | Niet-metaaloxiden |
| Productie | Een belangrijke industriële bron van CO is een mengsel dat voornamelijk koolmonoxide en stikstof bevat, gevormd door verbranding van koolstof in lucht bij hoge temperatuur wanneer er een overmaat aan koolstof is. In een oven wordt lucht door een bed van cokes gevoerd.
Het initieel geproduceerde CO2 reageert met de resterende hete koolstof om CO te geven. Boven 800 ° C is CO het overheersende product: CO2 + C → 2 CO (ΔH = 170 kJ / mol) Een andere bron is “watergas”, een mengsel van waterstof en koolmonoxide geproduceerd via de endotherme reactie van stoom en koolstof: H2O + C → H2 + CO (ΔH = +131 kJ / mol) Kan ook worden verkregen uit aardgas en andere brandstoffen. Koolmonoxide kan ook worden geproduceerd door hoge temperatuur elektrolyse van kooldioxide met vaste oxide elektrolyse cellen 2 CO2 → 2 CO + O2 MO + C → M + CO Koolmonoxide wordt ook geproduceerd door de directe oxidatie van koolstof in een beperkte hoeveelheid zuurstof of lucht. 2 C (s) + O2 → 2 CO (g) |
| Eigenschappen | Koolstofmonoxide of CO ruik je het niet, je ziet het niet en je proeft het niet. Door deze eigenschappen wordt de aanwezigheid vaak niet opgemerkt, wat jaarlijks zorgt voor heel wat (dodelijke) slachtoffers.
Koolstofmonoxide komt vrij bij de verbranding van fossiele brandstoffen zoals gas, hout, mazout, kolen en petroleum indien er onvoldoende zuurstof aanwezig is. |
| Toepassingen | Koolmonoxide wordt gebruikt als een voorloper van veel industriële chemicaliën. Alkenen kunnen in aldehyden worden omgezet.Deze aldehyden worden op hun beurt gebruikt als voorlopers voor detergentia en complexere moleculen.
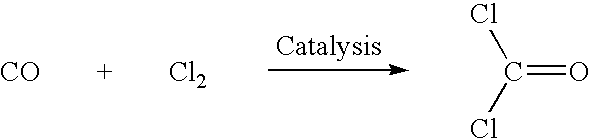
Fosgeen kan worden geproduceerd door chloorgas en koolmonoxide door een bed van actieve kool te leiden:Cl2 + CO → COCl2. Fosgeen is een belangrijke voorloper van vele polymeren en wordt elk jaar door miljoenen tonnen geproduceerd.
In de vorm van watergas wordt het veel gebruikt als brandstof bij industriële bewerkingen. Het gas is ook een effectief reductiemiddel. Wanneer bijvoorbeeld koolmonoxide over hete ijzeroxiden wordt geleid, worden de oxiden gereduceerd tot metallisch ijzer, terwijl het koolmonoxide tot koolstofdioxide wordt geoxideerd. In een andere toepassing wordt een mengsel van metaalertsen verwarmd tot 50-80 ° C in de aanwezigheid van CO. Alle oxiden behalve die van nikkel worden gereduceerd tot hun metallische toestand. Dit proces, dat bekend staat als het Mond-proces, is een manier om nikkel te scheiden van andere metalen waarmee het gewoonlijk voorkomt. |
| Geschiedenis | De vroege geschiedenis van gassen zoals koolmonoxide is soms moeilijk te traceren. Tot het begin van de 17e eeuw realiseerden wetenschappers zich niet dat het materiaal dat we lucht noemen in feite een mengsel van gassen is. Al in de late dertiende eeuw beschreef de Spaanse alchemist Arnold van Villanova (ca 1235-1311) een giftig gas gevormd door het verbranden van hout; dit gas was bijna zeker koolmonoxide.
De Vlaamse wetenschapper Jan Baptista van Helmont (ca. 1580-1644, sommige bronnen geven de datum van de dood als 1635) stierf bijna ten gevolge van het inademen van een mengsel van koolmonoxide en koolstofdioxide. Ontdekking van koolmonoxide wordt echter meestal toegeschreven aan de Engelse chemicus en theoloog Joseph Priestley (1733-1804). Tijdens de periode tussen 1772 en 1799 zag Priestley geleidelijk het verschil tussen koolstofdioxide en koolmonoxide en gaf hij correct de eigenschappen van het laatste gas. Elk jaar doodt koolmonoxide ongeveer 500 mensen in de Verenigde Staten Koolmonoxide is de doodsoorzaak voor 90 procent slachtoffers bij brand 50 procent van de koolmonoxide-incidenten gebeuren in huizen Koolmonoxide is minder dicht dan lucht De meest voorkomende bijwerkingen zijn hoofdpijn, misselijkheid en braken, zwakte en veranderende staten van bewustzijn Rooktabak verhoogt het koolmonoxideniveau in uw bloed Langdurige blootstelling aan lagere koolmonoxideniveaus kan tot een hart leiden |
| Bronnen | KLIK – KLIK – KLIK |