Bepalen van gehalte azijnzuur in huishoudazijn
Deel 1: Onderzoeksvraag
ONDERZOEKSVRAAG: Hoe kun je experimenteel het azijnzuurgehalte bepalen in huishoudazijn?
MOGELIJKE HYPOTHESEN:
- Door een titratie uit te voeren.
- Met een nucleonschaaltje.
Deel 2: Voorbereiden
Het gehalte van azijnzuur in huishoudazijn kan volumetrisch bepaald worden via een zuur–base titratie met natriumhydroxide volgens deze neutralisatiereactie.
THEORETISCHE VOORBEREIDING:

Wat is titreren en hoe moet het?
Welke indicator is geschikt bij deze titratie? Wat is het omslaggebied van de indicator?
Aan de hand van de pH berekening (zie berekeningen), kunnen we bepalen welke indicator we nodig hebben.
De geschikte indicator is fenolftaleïne. Het omslaggebied zoeken we via de volgende QR-code:

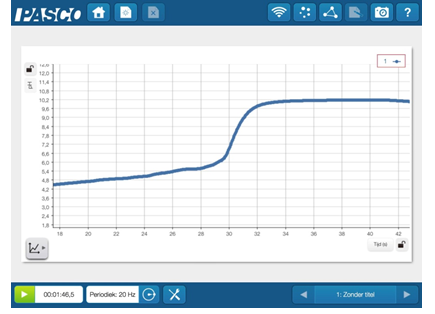
Het omslaggebied van fft is 8.2-10.
BENODIGDHEDEN:

Materiaal:
- Buret
- Statief
- Klemmen
- Erlenmeyer
- Pipet
- Wit blad
- Roermagneet
Stoffen:

- Tafelazijn
- Fenolftaleïne
- Natriumhydroxide 1,0 mol/l
- Gedestilleerd water

Etiketten:

Bereiding van de nodige oplossingen:
- Bereiding van 100 ml NaOH, 1,0 mol/l.
- Gegeven:
- M (NaOH) = 40 g/mol
- c = 1,0 mol/l
- V= 0, 1 l
- Gevraagd:
- Massa=?
- Oplossing:
- == 1,0 mol
- m(NaOH) = M.n = 40 g/mol . 1,0 mol = 40 g
- Gegeven:
Los 40 g NaOH op in 100 ml water.
- Berekening pH-waarde van het equivalentiepunt: Zouten afgeleid van een zwak zuur en een sterke base.
- Gegeven:
- c(CH3COOH )= 1,0 mol/l
- Gevraagd: pH= ?
- Oplossing:
- pH= 14 – pKb + logCO
- Gegeven:
OPSTELLING:
Deel3: Uitvoeren
![]()
Kalibreren:

Om de pH-meter op een correcte manier te gebruiken, moeten we deze alvorens we starten eerst kalibreren. Dit doen we door de meetsonde enkele seconden in een oplossing van pH 7 te dompelen en vervolgens enkele seconden in een oplossing van pH 4. Nadat we dit gedaan hebben, weet de applicatie wat pH 4 en 7 is, en kunnen we op een juiste manier meten.

Werkwijze:
- Vul de buret met NaOH-oplossing met gekende concentratie.
- Plaats de erlenmeyer met tafelazijn onder de buret.
- Voeg enkele druppels indicator toe aan de erlenmeyer.
- Meet het beginvolume van de NaOH-oplossing in de buret.
- Titreer met de NaOH-oplossing. Dit doe je door het kraantje een kwartslag te draaien.
- Meet het eindvolume van de NaOH-oplossing in de buret.
- Volg de pH-waarde met de meetsonde
Waarneming:

Deel4: Reflecteren

Besluit:
- verklaring van de waarneming:
Bij deze proef gaan we de base NaOH toevoegen aan een zure oplossing van tafelazijn. Nadat we enkele ml NaOH hebben toegevoegd zien we een lichte kleurverandering van geen kleur naar licht roze. Deze kleuromslag gebeurt door de indicator die we aan de oplossing hebben toegevoegd.
Na het meten met de pH-meter bekomen we een mooie titratiecurve. Hierop kunnen we aflezen dat het omslaggebied rond een PH van 8,2 ligt. We zijn van een lage pH naar een veel hogere pH gegaan.
- afleiding van nieuwe begrip/begrippen met definitie:
- Titratie
- De leerlingen kunnen een pH-buffer berekenen met de gegeven formule.
- met koppeling naar de onderzoeksvraag:
We kunnen het azijnzuurgehalte in tafelazijn bepalen door een titratie uit te voeren met de base NaOH.
Deel5: Didactische verwerking

Methodische verwerking als demo:
-leerkracht: Wanneer de leerkracht deze proef uitvoert, moet hij/zij zeer nauwkeurig werken. Daarnaast plaatst hij een wit blad onder de erlenmeyer, zodat de kleuromslag snel duidelijk wordt.
-leerling: De leerlingen kunnen deze proef alleen doen. Aan de hand van de voorziene filmpjes kunnen zijn deze proef uitvoeren. Hierdoor is er minder begeleiding nodig, ze kunnen namelijk steeds teruggrijpen naar de voorziene bron. Daarnaast moeten ze nauwkeurig te werk gaan!
-veiligheidsaspecten: We doen steeds een labojas en een veiligheidsbril aan. De leerlingen/leerkracht moeten extra voorzichtig zijn met fenolftaleïne en NaOH.
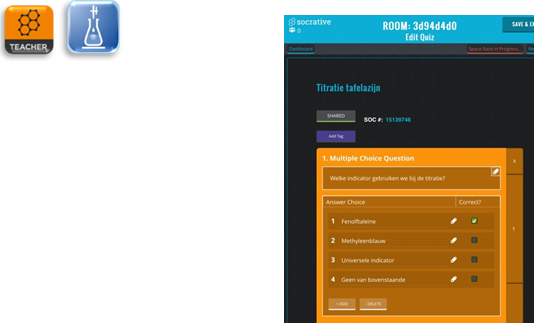
Deel 6: Kennisquiz of titratiespel
Deel 7: Verslag doorsturen
![]()







