Horlogeglas

Wat/Wie?
Begrip
Een horlogeglas is een rond, hol stuk glas dat in de chemie wordt gebruikt als oppervlak om een vloeistof te verdampen, om vaste stoffen vast te houden tijdens het wegen, om een kleine hoeveelheid substantie te verwarmen en als deksel voor een beker . Dit laatste gebruik wordt in het algemeen toegepast om te voorkomen dat stof of andere deeltjes in de beker komen; het horlogeglas sluit de beker niet volledig af, waardoor er nog steeds gasuitwisseling plaatsvindt. Bij gebruik als verdampingsoppervlak maakt een horlogeglas een nauwkeurigere observatie van precipitaten of kristallisatie mogelijk en kan het op een oppervlak met een contrasterende kleur worden geplaatst om de algehele zichtbaarheid te verbeteren. Horlogeglazen worden zo genoemd omdat ze lijken op het glas dat wordt gebruikt voor de voorkant van ouderwetse zakhorloges .
Een horlogeglas kan niet alleen worden gebruikt voor het waarnemen van neerslagpatronen en kristallen, het kan ook worden gebruikt voor het drogen van vaste stoffen. Wanneer verder drogen nodig is, wordt een horlogeglas vaak gebruikt in gevallen waarin een bepaald type vaste stof moet worden gescheiden van het relatief vluchtige oplosmiddel. De vaste stof wordt uitgespreid op een horlogeglas en vaak wordt er een gevouwen filterpapier boven geplaatst om te voorkomen dat deeltjes in de lucht het product verontreinigen. Om de droogsnelheid te maximaliseren, kan een horlogeglas in een zuurkast worden geplaatst om voldoende tijd voor een goede luchtcirculatie te zorgen. Een andere techniek die in chemische laboratoria wordt gebruikt om de droogsnelheid te verhogen, is door een zachte stroom droge lucht of stikstofgas over het horlogeglas te leiden vanuit een omgekeerde trechter erboven geklemd.
Weetjes
Er zijn twee soorten, glazen horlogeglazen en plastic horlogeglazen, die in het laboratorium worden gebruikt . Deze horlogeglazen zijn verkrijgbaar in verschillende maten en breedtes. Horlogeglazen zijn meestal dikker dan enig ander glas of plastic laboratoriummateriaal.
- Glazen horlogeglazen – Deze kunnen na sterilisatie in een autoclaaf of een laboratoriumoven opnieuw worden gebruikt . De gemaakte glazen bieden een hoge weerstand tegen thermische schokken , chemische weerstand en zijn bestand tegen mechanische duurzaamheid.
- Kunststof horlogeglazen – Dit zijn wegwerphorlogeglas dat wordt gebruikt in laboratoriumwerk om kruisbesmetting tijdens het voorbereiden van de monsters te voorkomen. Ze zijn erg goed in het implementeren bij lage temperaturen en hebben een werkbereik van -57 tot 135 ° C ; het is ook bestand tegen degradatie van UV-licht . Deze kunststof horlogeglazen zijn minder duur en licht in gewicht
Experiment
Materiaal + stoffen
- 2 proefbuizen
- 2 pasteurpipetten
- Wattenprop
- Horlogeglas
- IJzeren nagel
- Staalwol
- Maatbeker
- 2 ml CuSO4-oplossing 0,1mol/l
- 2 ml NH3-oplossing 1,0 mol/l
Opstelling (foto)

Uitvoeren
Werkwijze
Deel 1:
- Schuur de ijzeren nagel op met staalwol.
- Maak vervolgens een wattenprop nat, en leg deze op het horlogeglas zodat het water langer behouden blijft.
- Leg dan de afgeschuurde nagel op de natte wattenprop.
Deel 2:
- Breng in een proefbuis 2 ml CuSO4. Dit doe je door eerst een kleine hoeveelheid in een maatbeker te gieten en vervolgens met de pasteurpipet 2 ml over te pipetteren in de proefbuis.
- Breng in de andere proefbuis 2 ml NH3. Dit doe je volgens dezelfde manier als met CuSO4. Spoel eerst de maatbeker even uit!
- Giet nu de 2 vloeistoffen samen en noteer je waarneming..
Waarneming (+ foto’s)
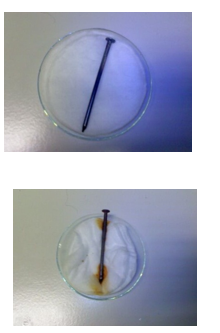

- Deel 1:
- Welke kleur heeft de droge spijker?
- Grijs.
- Welke kleur heeft de spijker op de natte wattenprop na 5 minuten?
- Nog steeds grijs.
- Deel 2:
- Welke kleur heeft de CuSO4– oplossing?
- Lichtblauw.
- Welke kleur krijgt de oplossing na toevoeging van NH3?
- Felblauw.
- Hoelang duurt het voor er kleurverandering optreedt?
- De reactie treedt onmiddellijk op.
Reflecteren
Vergelijk de snelheid van beide reacties met elkaar. Wat kun je vaststellen?
De tweede reactie treedt onmiddellijk op, de eerste reactie treedt traag op.
Optredende reacties:
4 Fe + 3 O2 –> 2 Fe2O3 (trage reactie)
Cu2+ + 4 NH3 –> Cu(NH3)42+ (tetramminekoper(II)ion)






