Het begrip molaire massa
Zoals we reeds gezien hebben, drukken we het aantal atomen in een stof uit in mol. Dit noemde we het getal van Avogadro (NA). Hoeveel atomen zaten er in 1 mol?
……………………………………….
Weegt 1 mol aluminium evenveel als 1 mol koper? Waarom wel of waarom niet?
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
We hebben met andere woorden nog een begrip nodig. Surf naar volgende URL:
http://dmentrard.free.fr/GEOGEBRA/Sciences/Chimie/Chimie/mole.html
Indien dit niet lukt, probeer de link te openen in een andere browser of controleer of Java
geactiveerd is in je huidige browser.
Je verkrijgt nu volgend scherm:
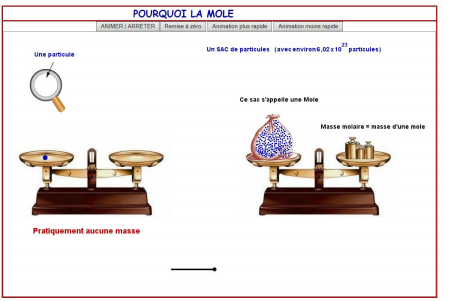
Klik op ‘ANIMER/ARRETER’. Hoeveel deeltjes zitten er in de zak?
…………………………………………………….
Wat geven de gewichtjes aan de rechterkant op de balans weer?
………………………………………………………………………………………………….
Hoe noemt men in de animatie deze massa?
…………………………………………………………………………………………………….
Zou deze voor elke stof hetzelfde zijn? Verklaar je antwoord.
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
Het begrip molaire massa geeft dus de massa weer van 1 mol van die stof.
Molaire massa = M = m/n (g/mol)
Per atoomsoort kan je de molaire massa terugvinden in de tabel van Mendelejev. Bij atoomsoorten spreekt men naast molaire massa ook van relatieve atoommassa. Let op, relatieve atoommassa kan niet gebruikt worden in verbindingen en zijn enkel van toepassing op elementen! Zo vinden we bijvoorbeeld voor het element kwik het volgende:
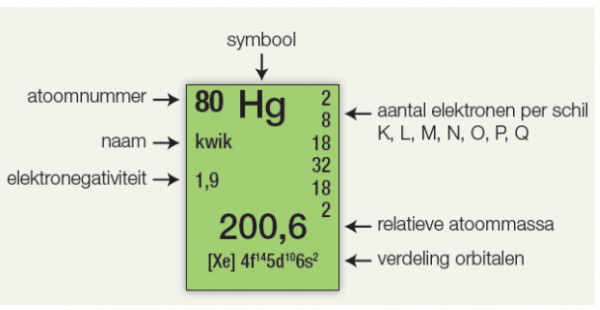
Wat is de molaire massa van kwik?
…………………………………………………
Eén mol kwik zal met andere woorden 200,6 gram wegen.
Om dit begrip wat beter in te oefenen, gaan we werken met een digitale oefening. Surf hiervoor naar
de volgende URL:
http://www.echalk.co.uk/Science/chemistry/mole/moleIntro.html
Klik vervolgens op ‘calculate number of moles’. Je komt nu uit op volgend scherm:

Nu sleep je één van de stoffen op de weegschaal. Vul onderstaande gegevens in voor jou gekozen stof.
Atoomsoort: …………………………………….
Symbool: ………………………………………….
Molaire massa: …………………… (deze vind je dus ook in je PSE terug)
Massa van het voorwerp: ………………..
Met deze gegevens zou je in staat moeten zijn om het aantal mol te berekenen van het voorwerp, met de formule M = m/n.
Hoeveel mol zit er in desbetreffend voorwerp?
………………………………………………………..
Door op ‘show’ te klikken, kan je controleren of je antwoord juist is.
Doe hetzelfde voor nog twee stoffen.
1)
Atoomsoort: …………………………………….
Symbool: ………………………………………….
Molaire massa: ………………………………..
Massa van het voorwerp: ………………..
Aantal mol in het voorwerp: …………..
2)
Atoomsoort: …………………………………….
Symbool: ………………………………………….
Molaire massa: …………………………………
Massa van het voorwerp: ………………..
Aantal mol in het voorwerp: ……………
Je kunt de oefening ook aanpassen door de relatieve atoommassa bedekt te houden en het aantal mol te laten zien. Je hebt in dat geval dus de massa en het aantal mol van het voorwerp gegeven.
Hieruit kan je zelf de relatieve atoommassa berekenen.
Doe dit voor 2 stoffen:
1)
Atoomsoort: …………………………………….
Symbool: ………………………………………….
Massa van het voorwerp: ………………..
Aantal mol in het voorwerp: ……………
Molaire massa: ………………………………
2)
Atoomsoort: …………………………………….
Symbool: ………………………………………….
Massa van het voorwerp: ………………..
Aantal mol in het voorwerp: ……………
Molaire massa: ………………………………
Als de oefeningen lukken, mag je ook proberen de moeilijkheidsgraad linksonder op moeilijk te
zetten. Dit zorgt ervoor dat de berekeningen iets uitdagender worden.






