Geometrie
1) Schets de lewisstructuur van H2O.
De lewisstructuur doet vermoeden dat de bindingshoek tussen de bindingen in H2O 180° bedraagt, m.a.w. dat een watermolecule een rechtlijnige molecule is. Toch blijkt uit experimenten dat de bindingshoek niet 180° is maar 104,5°. Dit kan verklaard worden uit de geometrie van de moleculen. Deze geometrie onderzoek je in deze BZL.
2) Op de simulatie in onderstaande link. Opgelet, werk in Mozilla Firefox! Kies voor “model”.
De link vind je eveneens in smartschool bij “weblinks” https://phet.colorado.edu/nl/simulation/molecule-shapes
3) Bouw een molecule met 2 enkelvoudige bindingen. Je kunt deze molecule roteren om ze duidelijk te kunnen bezichtigen.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
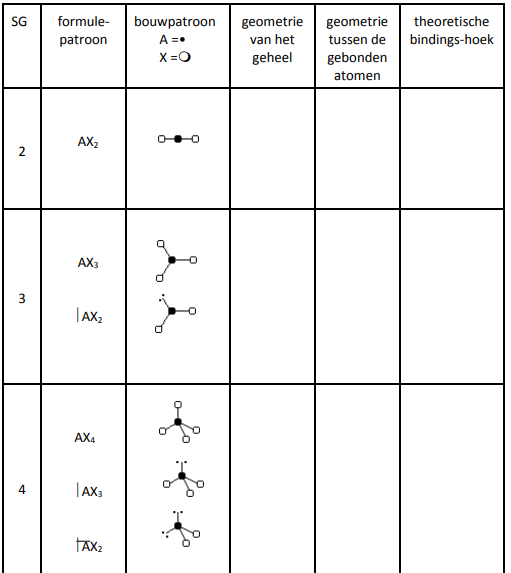
– Bereken het sterisch getal van het centrale atoom ( = SG = som van sigmabindingen1 en vrije elektronenparen)
SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal2-piramide – tetraëder3
.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair4 – tetraëder
…………………………………………………….

4) Bouw een molecule met 1 enkelvoudige binding en 1 dubbele binding.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
– Bereken het sterisch getal van het centrale atoom SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
…………………………………………………….
5) Bouw een molecule met 3 enkelvoudige bindingen.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
– Bereken het sterisch getal van het centrale atoom SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
…………………………………………………….
6) Bouw een molecule met 2 enkelvoudige bindingen en 1 vrij elektronenpaar.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
– Bereken het sterisch getal van het centrale atoom SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
…………………………………………………….
7) Bouw een molecule met 1 enkelvoudige binding, 1 dubbele binding en 1 vrij elektronenpaar.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
– Bereken het sterisch getal van het centrale atoom SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
…………………………………………………….
8) Bouw een molecule met 4 enkelvoudige bindingen.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
– Bereken het sterisch getal van het centrale atoom SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
…………………………………………………….
9) Bouw een molecule met 3 enkelvoudige bindingen en 1 vrij elektronenpaar.
– Hoeveel bedraagt de bindingshoek? (je kunt deze laten projecteren) ……………
– Bereken het sterisch getal van het centrale atoom SG = ………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
………………………………
– Benoem de geometrie van de gebonden atomen. Kies uit lineair – geknikt – trigonaal -piramide – tetraëder.
……………………………………………………..
– Benoem de geometrie van het geheel (inclusief vrije elektronenparen). Kies uit: lineair –planair – tetraëder
…………………………………………………….
12) Vat alle informatie samen in onderstaande tabel.
13) OEFENINGEN
Voorspel op basis van de tabel (zie boven) en het sterisch getal de geometrie van onderstaande moleculen. Teken hiervoor telkens eerst de lewisformule, daarna bepaal je het sterisch getal en de geometrie. Tot slot controleer je je resultaten met de animatie (kies deze
keer “echte moleculen”). Opgelet, de theoretische bindingshoek kan verschillen van de werkelijke, in de tabel schrijf je eerst de theoretische, na controle schrijf je de werkelijke er in potlood achter.
a) H2O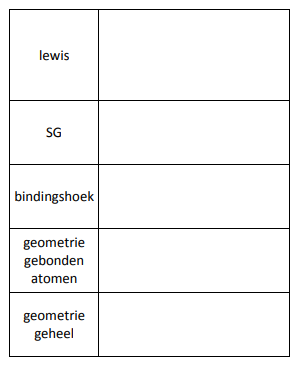
b) CO2
c) SO2
d) NH3
e) CH4
14) Vergelijk de Lewisformules van CH4, NH3 en H2O. Waarin verschillen ze? Vergelijk eveneens de werkelijke bindingshoeken van CH4, NH3 en H2O. Vul volgend tekstje aan. Baseer je op je bevindingen.
Hoe meer vrije elektronenparen er rond een centraal atoom zitten, hoe …………………………de bindingshoek. Dit komt omdat een vrij elektronenpaar meer ruimte inneemt dan een bindend elektronenpaar. Hierdoor worden de bindingen meer naar elkaar toe geduwd






