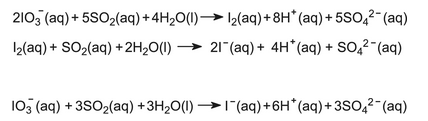Dijood

| Formule | I2 |
| Familie | Niet-metalen |
| Productie | Productie Dijood wordt verkregen van: a) pekel die jodide-ionen bevat b) nitraatertsen Van pekel Pekel die 100-150 ppm jodium bevat onder de vorm van jodide- wordt gezuiverd en aangezuurd met zwavelzuur. Het wordt dan gechloreerd om het jodium vrij te zetten:
Twee manieren worden gebruikt om het jodium te zuiveren: Het vrijgemaakte jodium wordt in een extractietoren verwijderd door een tegenstroom van lucht. De jodiumrijke lucht stroomt in een absorberende toren wordt behandeld met een oplossing van zwaveldioxide, die het jodium tot waterstofjodide omzet.
Het grootste deel van de oplossing wordt opnieuw met chloor omgezet en het geproduceerde jodium laat men bezinken, terug smelten en vervolgens in vlokken omgezet. KLIK De rest van de oplossing wordt gerecycled naar de absorptietoren. De gestripte pekel wordt teruggebracht naar zijn bron. 99,5% zuiver jodium wordt verkregen.
De I3-ionen worden geadsorbeerd op een anionisch uitwisselingshars. De hars wordt overgebracht naar een andere kolom, waar een oplossing van zwaveldioxide doorheen druppelt om de jodide-ionen te regenereren De reactie kan dus worden voorgesteld: Net als bij het uitblazen wordt deze oplossing opnieuw verwarmd met dichloor en wordt dijood vrijgemaakt en gezuiverd. (b) uit nitraatertsen In Chili komt jodium voor in nitraatafzettingen als jodaat-ionen (IO3–). Het erts bevat ongeveer 95% natriumnitraat en 5% natriumjodaat, NaIO3.
De algemene reactie is dus:
De oplossing van de absorptietoren wordt gemengd met een kleine hoeveelheid van de oplossing die jodaationen bevat om vrij jodium vrij te maken:
Het vaste jood wordt in flotatiecellen van de oplossing gescheiden. Het jood wordt geëxtraheerd met behulp van kerosine. De jodium / kerosinesuspensie passeert in een reactor en wordt verwarmd tot 400 K en bij een druk hoger dan atmosferische druk. Het gesmolten dijood wordt verwijderd en afgekoeld om een vast product te krijgen. |
| Eigenschappen |
Eigenschappen Jodium is een niet-metaalachtig, donkergrijs / paarszwart, glanzend, vast element. Jodium is het minst reactieve van de halogenen, Jodium verhit gemakkelijk en geeft een paarse damp. KLIK Jodium lost op in sommige oplosmiddelen, zoals koolstoftetrachloride, en het is slechts slecht oplosbaar in water. |
| Toepassingen | Jodium is een belangrijk onderdeel van het dagelijks leven. Een lichaam moet jodium hebben, maar het lichaam kan het niet produceren. De schildklier heeft jodium nodig om hormonen te creëren. Als de schildklier minder jodium krijgt, zal de schildklier harder moeten werken om hormonen te maken. Er zijn ernstige bijwerkingen die kunnen optreden als er een tekort aan jodium in het menselijk lichaam is, zoals auto-immuunziekte en schildklierkanker.
Om jodium in uw lichaam te krijgen, moet u het in uw dieet hebben. Het is moeilijk om jodium in voedingsmiddelen te vinden, tenzij het aan uw voedsel is toegevoegd. Jodium is te vinden in alledaagse voedingsmiddelen zoals biologische yoghurt, aardbeien, aardappelen, veenbessen en zeegroenten. Ontsmettingsmiddel: jodiumtinctuur Identificatie van zetmeel KLIK |
| Geschiedenis | Dijood werd ontdekt door de Franse chemicus Barnard Courtois in 1811. Courtois extraheerde natrium- en kaliumverbindingen uit as van zeewier. KLIK Nadat deze verbindingen waren verwijderd, voegde hij zwavelzuur (H2SO4) toe om de as verder te verwerken. Hij voegde per ongeluk te veel zuur toe en een violet gekleurde wolk kwam vrij. Het gas condenseerde op metalen voorwerpen in de kamer, waardoor een vast jodium ontstond. Tegenwoordig wordt jodium voornamelijk verkregen uit afzettingen van natriumjodaat (NaIO3) en natriumperjodaat (NaIO4) in Chili en Bolivia. |
| Bronnen | KLIK |