Covalente binding in water
VIDEO: http://www.inquiryinaction.org/f/chapter_1/water_covalent_bond.wmv
Onderzoeksvraag:
Hoe kunnen twee verschillende niet-metalen een binding vormen?
De binding tussen 2- H atomen (metaal) en 1 O-atoom (niet-metaal) in H2O.
Instructie:
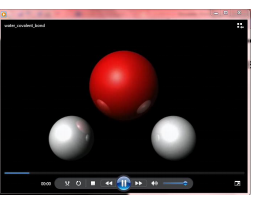
Kijk aandachtig naar het filmpje. Probeer, na het bekijken van het filmpje, een antwoord te formuleren op volgende vragen:
1. Welke kleur stellen het waterstofatoom voor?
2. Welke kleur stelt het zuurstofatoom voor?
3. Wat gebeurt er met de atomen?
Waarneming:
1. De waterstofatomen hebben een witte kleur.
2. Het zuurstofatoom is voorgesteld door de rode kleur.
3. De atomen gaan met elkaar een binding aangaan.
Besluit:
Teken de valentie-elektronen van elk atoom.
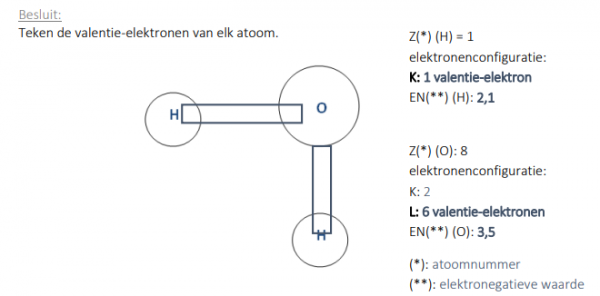
Elke atoom wil de edelgasconfiguratie bereiken.
Twee H-atomen stellen elk één valentie-elektron en een O-atoom stelt twee valentie-elektronen ter beschikking voor de vorming van twee gemeenschappelijke elektronenparen.
(Duid deze aan in het blauw)
Voorstelling volgens de Lewis-notatie:
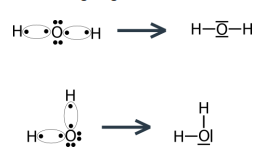
De ∆ EN tussen de bindingspartner is klein, want 3,5 – 2,1 = 1,4. Dat wil zeggen dat bij de atoombinding of covalente binding tussen verschillende niet-metalen ∆EN < 1,6.
De EN-waarde geeft aan hoe sterk een element de neiging heeft om gebonden elektronenpaar zich toe te trekken.






