Balanceren van reactievergelijkingen
Inleiding
We hebben al geleerd hoe we coëfficiënten moeten aanpassen om de reactievergelijking in evenwicht te brengen. Bijvoorbeeld de reactie tussen natrium en zwavel is de volgende:
Na + S –> Na2S
Deze reactie is niet in evenwicht. Bij het reagentia hebben we in totaal 1 Na-atoom en 1 S-atomen, bij het reactieproduct hebben we 2 Na-atomen en 1 S-atoom. Dit kan niet volgens de wet van behoud van atomen. Door het aanpassen van de coëfficiënten,
2Na + S –>Na2S , zijn het aantal atomen van reagentia en reactieproduct gelijk. We hebben dan altijd gezegd dat in dit geval de reactie volledig op gaat gaan. Wanneer gaat een dergelijke reactie dan niet volledig op? Wat zijn de mogelijkheden?
Nieuwe begrippen
Open de webbrowser fire fox of internet explorer en open de applicatie met de volgende link:
https://phet.colorado.edu/nl/simulation/legacy/reactants-products-and-leftovers .
In de plaats van chemische stoffen maken we het probleem even concreter door te werken met boterhammen. Om een broodje kaas te maken heb je brood en kaas nodig. Om één broodje kaas te maken heb je in totaal 2 sneden brood en 1 plakje kaas nodig. Controleer dit met de simulatie.
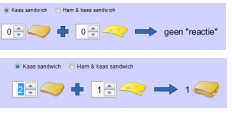
Bovenaan zie je het volgende staan. Met 0 sneden brood en 0 plakjes kaas kan je geen boterham maken.
Pas daarom het aantal sneden en plakjes aan om één broodje kaas te maken. Dit stelt onze chemische reactie voor.
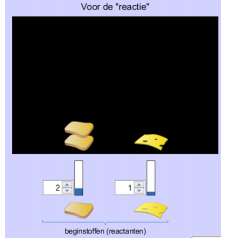
Zoals eerder gezegd hebben we 2 sneden brood en 1 plakje kaas nodig om een broodje kaas te maken. Doe dit onderaan door
het aantal aan te passen onder “Voor de reactie”‘. Bekijk het resultaat onder “Na de reactie”.
Conclusie: We hebben dus met 2 sneden brood en 1 plakje kaas perfect één broodje kaas kunnen maken.
Probleem: Wat zou er gebeuren als ik 6 sneden brood had en 2 plakjes kaas? Test dit nu eerst met de simulatie.
Vul de aantallen van het probleem hier in de tabel in.
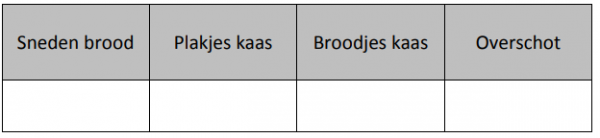
We zien dat we wat overschot hebben. We kunnen nu niet perfect drie broodjes kaas maken, maar juist twee. In dit voorbeeld hadden we niet genoeg kaas. Het aantal broodjes kaas dat we konden maken was dus gelimiteerd door het aantal plakjes kaas (2 in dit geval).
De kaas was in dit voorbeeld het limiterende bestanddeel.
We hebben een overschot aan brood over. We kunnen dan ook zeggen dat we teveel brood voorzien
hadden.
Het brood was in dit voorbeeld in overmaat.
Probleem: Wat zou dit nu betekenen voor een chemische reactie?
Herleid het probleem van de broodjes kaas naar de reactie tussen natrium en zwavel op de vorige
pagina:
6Na + 2S –> 2Na2 S + 2Na
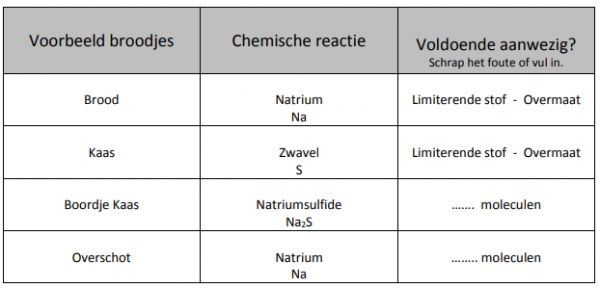
Besluit:
Niet alle reacties gaan in evenwicht zijn. We moeten ze zelf nog in evenwicht brengen. Als we dit niet doen gaat de reactie niet volledig opgaan. Er gaat van één reactieproduct teveel zijn en van het andere te weinig. Het reagentia waar te veel van is, is in overmaat aanwezig. Het reagentia waar te weinig van is noemen we de limiterende stof. De limiterende stof is verantwoordelijk voor hoeveel
reactieproduct er maximaal gevormd kan worden.
Oefeningen
Ga nu naar het tabblad “Echte reactie” bovenaan en klik het voorbeeld “Maak water” aan.
De reactie is al in evenwicht gebracht.
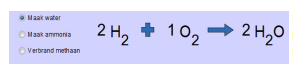
Om 2 moleculen water te maken moeten 2 moleculen H2 en 1 molecule O2 met elkaar reageren.
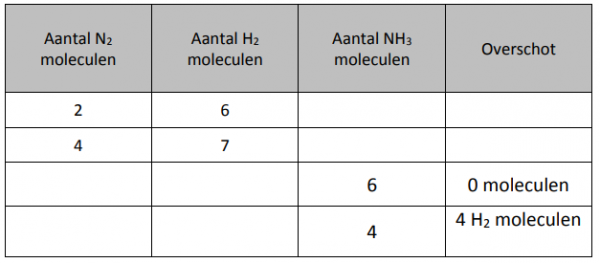
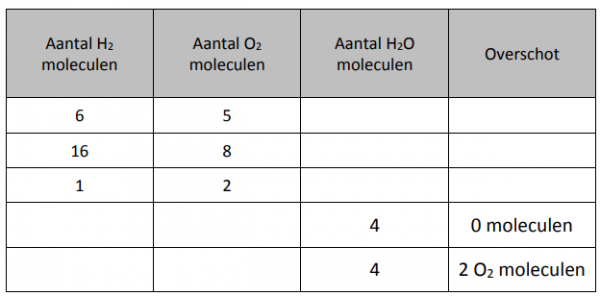
Opdracht: In de tabel staat hoeveel moleculen van ieder reagentia je gaat gebruiken. Vul daarmee de rest van de tabel in. Als er een limiterend reagentia is, omcirkel deze dan steeds in iedere rij. Controleer daarna met de simulatie.
Klik nu bovenaan “Maak ammonia” aan. Doe hetzelfde maar nu met vorming van ammonia. Vergeet de het limiterende reagentia te omcirkelen.
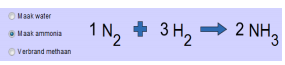
De reactie is al in evenwicht gebracht. Om 2 moleculen ammonia te maken moeten 3 moleculen H2 en 1 molecule N2 met elkaar reageren.