Balanceren reactie met limiterende stoffen
Inleiding en beginkennis
In vorige lessen heb je gezien hoe je het aantal mol van een stof en de concentratie van een
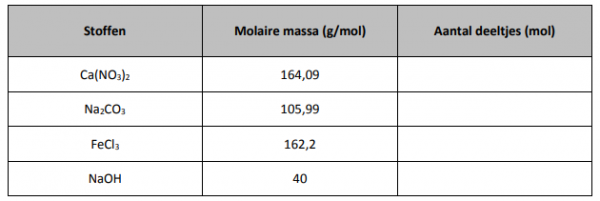
oplossing moet berekenen. Voordat je begint moet je eerst de volgende tabel invullen voor 20 gram van iedere stof.
Bij het schrijven van een chemische reactie moeten de coëfficiënten altijd aanpassen. Zo kan je afleiden hoeveel mol deeltjes met elkaar moeten reageren opdat de reactie volledig zal opgaan. Bij verbranden van magnesium is dit de reactievergelijking: 2 Mg + O2 –> 2 MgO .
Tussen magnesium en dizuurstof is er een 2:1 verhouding.
Opdrachten
Ga nu naar: http://employees.oneonta.edu/viningwj/sims/limiting_reactants_s.html
Dit is een simulatie waarbij je 5 verschillende reacties kan laten lopen en je kan zelf kiezen hoeveel gram stof je steeds neemt.
In deze opdracht moeten jullie alleen maar de laatste 4 reactievergelijkingen testen door ze aan te klikken. De eerste wordt in een
voorbeeld uitgewerkt
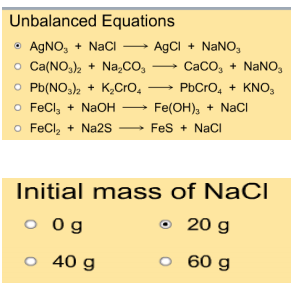
Aan de rechterkant kan je kiezen hoeveel gram stof (reagentia 2) je wilt gebruiken voor de reactie.
Links onder staan twee knoppen. 
Met deze kan je een bepaalde hoeveelheid stof (reagentia 1) toevoegen.
Rechts onderaan vind je een staafdiagram die weergeeft hoeveel stof je gebruikt hebt en hoeveel er gaat reageren volgens de geselecteerde reactievergelijking. 
Voorbeeld:
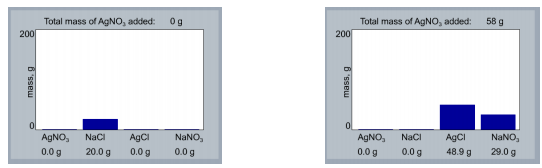
Voor de eerste reactie:
AgNO3 + NaCl –>AgCl + NaNO3
is er een 1:1 mol verhouding tussen AgNO3 en NaCl. In de staafdiagram zien we dat we 20 gram NaCl namen. Dit komt overeen met 0,34 mol NaCl. Opdat de reactie volledig zou opgaan moeten we dus ook 0,34 mol AgNO3 hebben om te reageren met alle NaCl (0,34 mol). Na berekenen komt 0,34 mol AgNO3 overeen met een massa van 58,1 gram. We voegen dus met de knoppen links onderaan 58 gram AgNO3 toe. Het resultaat is dat alle NaCl is weg gereageerd. De reactie is nu volledig opgegaan. Als we meer AgNO3 zouden
toevoegen, zou er een overmaat AgNO3 zijn en NaCl de limiterende stof.
OPDRACHT 1: Doe nu hetzelfde voor de onderstaande reacties. Let wel op dat de coëfficiënten niet altijd correct zijn. Controleer dit met de simulatie. De molaire massa’s vind je in de tabel op pagina 1.
Zorg ervoor dat alle reacties volledig opgaan.
Ca(NO3)2 + Na2CO3 –> CaCO3 + NaNO3
FeCl3 + …. NaOH –>Fe(OH)3 + …. NaCl
Reactie 1:
…..Ca(NO3)2 + ……Na2CO3 –> ….CaCO3 + ….NaNO3
Geg: m(Na2CO3) = 20,0 g gevr: m(Ca(NO3)2) = ? g
Opl:
Reactie 2: FeCl3 + …. NaOH –>Fe(OH)3 + …. NaCl
Geg: m(NaOH) = 20,0 g gevr: m(FeCl3) = ? g
Opl:
OPDRACHT 2: Ga bij de volgende reacties na welke stof in overmaat is en welke stof de limiterende stof is als je …
1) 40 gram Na2S gebruikt en 70 gram FeCl2. M(Na2S) = 78 g/mol , M(FeCl2) = 126,75 g/mol.
…..FeCl2 .+….Na2 S –>…FeS + …..NaCl
Bewerkingen
……………………………………..……………………………………..……………………………………..……………………………………..
……………………………………..……………………………………..……………………………………..……………………………………..
……………………………………..……………………………………..……………………………………..……………………………………..
……………………………………..……………………………………..……………………………………..……………………………………..
Besluit: In deze reactie is ………..….. in overmaat en ……………… de limiterende stof. Er blijft nog ………….. gram …………….. over. De reactie gaat wel/niet volledig op.
2) 60 gram K2CrO4 gebruikt en 36 gram Pb(NO3)2 . M(K2CrO4) = 194,2 g/mol en M(Pb(NO3)2) = 331,2 g/mol.
…..Pb(NO3)2 +…..K2CrO4 –>…..PbCrO4 +…..KNO3
Bewerkingen
……………………………………..……………………………………..……………………………………..……………………………………..
……………………………………..……………………………………..……………………………………..……………………………………..
……………………………………..……………………………………..……………………………………..……………………………………..
Besluit: In deze reactie is ………..….. in overmaat en ……………… de limiterende stof. Er blijft nog ………….. gram …………….. over. De reactie gaat wel/niet volledig op.






