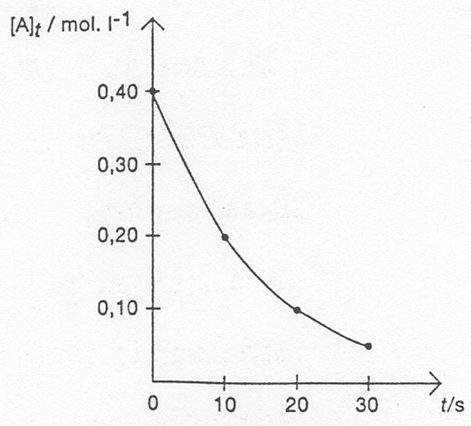
Snelheidswet
Definities
snelheidsvergelijking: De snelheidsvergelijking laat toe de relatie tussen de concentratie van de reagentia en de reactiesnelheid te voorspellen.
Experimenten
Filmfragmenten
Eigen lesvideo's
Oefeningen lesvideo's
Snelheidswet
- Schrijf voor elk van de onderstaande reacties de uitdrukking van de ogenblikkelijke reactiesnelheid (snelheidswet), in de veronderstelling dat het éénstapsreacties zijn. Na2S2O3(opl) + 2 HCl(opl) –> SO2 + S + 2 NaCl (opl) + H2O
- Schrijf voor elk van de onderstaande reacties de uitdrukking van de ogenblikkelijke reactiesnelheid (snelheidswet), in de veronderstelling dat het éénstapsreacties zijn. Mg(v) + 2 HCl(opl) –> MgCl2(opl) + H2(g)
- Schrijf voor elk van de onderstaande reacties de uitdrukking van de ogenblikkelijke reactiesnelheid (snelheidswet), in de veronderstelling dat het éénstapsreacties zijn. CH3COOH(opl)+ CH3CH2OH(opl) –> CH3COOC2H5(vl) + H2O
Orde van reactie
3. Gegeven= A(opl) + 2 B(opl) –> C(opl)
Vervolledig de onderstaande tabel
Maak grafische voorstellingen:
Reactievergelijking: A + 2 B –> C
5. Beschouw de reactie: 3A + B –> C+D
Spellen
Quizzen
Animaties
Ipad apps
Android apps
Reactiesnelheid

De app geeft info voor het oplossen van allerlei soorten chemische kinetiekproblemen. Het gaat over tijdsafhankelijke kwantitatieve analyse van chemische reacties. Specifiek lost deze toepassing chemische reactiesnelheidsvergelijkingen op en verschaft grafische weergave van reagens en productconcentratie versus tijd. Daarnaast berekent de app halveringstijden en evenwichtsconstanten, waar deze geschikt is.
https://play.google.com/store/apps/details?id=com.androVR.chemicalkinetics
App om de snelheid van de chemische reactie, reactiesnelheid formule, chemische kinetiek, factoren die van invloed reactiesnelheid op een eenvoudige en boeiende manier te visualiseren
https://play.google.com/store/apps/details?id=com.ajax.rateofreactions&gl=BE

Deze app helpt bij het meten van de reactiesnelheden
https://play.google.com/store/apps/details?id=com.chrysalis.reactionratecalculator&gl=BE
Inspiratie op het net
Snelheid van een reactie
- Wikiwijs lespakket
- Wikiwijs begrip reactiesnelheid
- Wikiwijs meten van reactiesnelheid
- Wikiwijs reactiekinetiek
- wikiwijs reactiesnelheid en evenwicht
- wetenschap reactiesnelheid en factoren lespakket
- wetenschap reactiesnelheid en factoren lespakket
- wetenschap meten van reactiesnelheid
- Klascement reactiesnelheid zelfstudie
- klascement studie van reactiesnelheid labo
- mlo chemie reactiesnelheid
- toelatingsexamen geneeskunde oefeningen chemische kinetiek
- toelatingsexamen uitdrukkingen rond reactiesnelheid
- internetboek reactiesnelheid