Waterstofnitriet
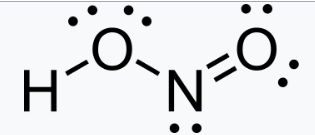
| Formule | HNO2 |
| Familie | anorganische zuren |
| Productie |
Salpeterigzuur wordt meestal gegenereerd door verzuring van waterige oplossingen van natriumnitriet met een mineraal zuur . Het aanzuren wordt gewoonlijk uitgevoerd bij lage temperatuur. Salpeterigzuur is onstabiel en ontleedt snel. Salpeterigzuur kan ook worden geproduceerd door distikstoftrioxide in water op te lossen volgens de vergelijking:N2O3 + H2O → 2 HNO2 Een lichtblauw oplossing van HNO2 wordt verkregen. Een andere gebruikelijke werkwijze voor het bereiden van salpeterig zuur door omzetting van natriumnitriet (NaNO2 ) met minerale zuren (zoals HCI, HBr, etc.). NaNO2 + H + —-> HNO2 + Na + |
| Eigenschappen |
Het ontleedt langzaam bij kamertemperatuur – en sneller bij verhoogde temperaturen – tot salpeterzuur en stikstofoxide. Salpeterigzuur wordt geoxideerd tot salpeterzuur door actieve oxidatiemiddelen en werkt als een oxidatiemiddel met sterke reductiemiddelen. Salpeterzuur (HNO 2 ) is een zwak zuur dat alleen in oplossing of als nitrietzouten voorkomt. |
| Toepassingen |
HNO2 wordt gebruikt voor de basis van zouten en esters. Anorganische nitrieten worden gebruikt als antioxidanten, bijvoorbeeld witte wijn. Enkele vaatverwijdende geneesmiddelen zijn nitriet-esters. Het is nuttig bij het omzetten van aminen in diazonium verbindingen die worden gebruikt bij het maken azokleurstoffen HNO 2 + ArNH 2 + H + → ArN = NAr + 2 H20 (Ar is een arylgroep) |
| Geschiedenis |
Salpeterigzuur, is ontstaan uit salpeterzuur. Salpeterzuur is gevormd door het samen verhitten van salpeter, blauwe vitriool en aluin. In de 13de eeuw hebben ze het zuur aangewend om goud en zilver van elkaar te kunnen onderscheiden. In de 17de eeuw is het gelukt om het zuur te bereiden door zwavelzuur en kaliumnitriet. |
| Bronnen | KLIK – KLIK |






