Polariteit
Opstart
Teken één molecule water volgens de Lewisstructuur.
Denk aan de bindingshoek!
Wat is de elektronegatieve waarde van het zuurstofatoom?
Wat is de elektronegatieve waarde van de waterstofatomen?
Welke atoomsoort zal de elektronen dus meer naar zich toe trekken?

We kunnen dit noteren op een Lewisstructuur aan de hand van een delta min (δ–) en een delta plus (δ+) op de atomen te tekenen.
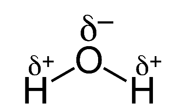
We zien dat door deze partiële ladingen het watermolecule op bovenstaande figuur licht negatief geladen is aan de bovenkant / onderkant en licht positief geladen aan de bovenkant / onderkant. (schrap wat niet past)
We spreken van een dipoolmolecule.

Op onderstaande tekening staat de Lewisstructuur van hexaan (C6H14).
Teken hierop bij elk atoom de partiële lading. Raadpleeg je PSE voor de elektronegatieve waarden.
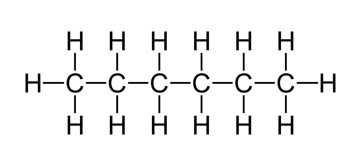
Heeft dit molecule partiële ladingen?
Is dit molecule een dipoolmolecule? Heeft het met andere woorden een licht positieve en licht negatieve kant?
Verklaar je antwoord:
Vul onderstaand kader aan:
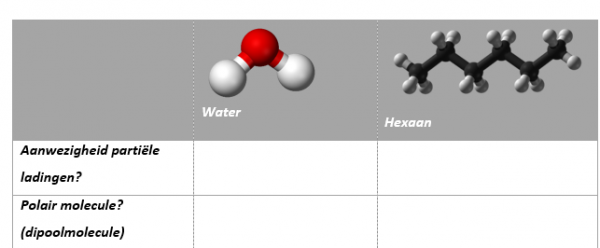
Bekijk nu de simulatie op onderstaande link en beantwoord onderstaande vragen:
APP http://www.deciencias.net/proyectos/0cientificos/Tiger/paginas/Polar_vs_Nonpolar.html
Wat bevindt zich in de erlenmeyer?
Wat bevindt zich in de maatbeker?
Wat gebeurt er met de water- en hexaanmoleculen wanneer men deze bij elkaar voegt?
Hoe kan je dit verklaren? Gebruik hierbij zeker de begrippen polair/apolair.
Hoe liggen op het einde de twee stoffen ten opzichte van elkaar?
Waarom ligt het hexaan vanboven?
Conclusie
(schrap wat niet past):
Polaire moleculen trekken polaire / apolaire moleculen aan.
Apolaire moleculen trekken polaire / apolaire moleculen aan.






