Limiterend reagens
1. Inleiding
Bij een chemische reactie moet je kijken naar de hoeveelheden stoffen die je gebruikt als je een experiment wilt uitvoeren. Zo mag je niet een willekeurige hoeveelheid NaOH bij een bepaalde hoeveelheid HCl doen. De reactievergelijking wordt als volgt gegeven:
NaOH + HCl –>NaCl + H2O
In deze reactie gaat 1 mol NaOH reageren met 1 mol HCl. We moeten dus eenzelfde verhouding NaOH en HCl hebben als we willen dat deze reactie volledig opgaat!
Bij verbranding van magnesium komt er een fel licht vrij. Deze reactie kunnen we schrijven als:
2Mg + O2 –>2MgO
We zien nu dat we 2 mol magnesium nodig hebben en maar 1 mol zuurstofgas.
Verhoudingen zijn heel belangrijk bij chemische reacties. Bij de eerste reactie is er tussen NaOH en HCl een 1:1 verhouding. Bij de tweede reactie is er een 2:1 verhouding. Als we ons houden aan deze verhoudingen gaat de reactie volledig opgaan.
Deeltjesmodel van een 2:1 verhouding: Er zijn 2 keer zoveel grijze deeltjes (6) dan rode deeltjes (3). Als zij reageren krijgen we een nieuwe stof en alle reagentia (grijze en rode deeltjes) zijn opgebruikt. De reactie is volledig opgegaan.
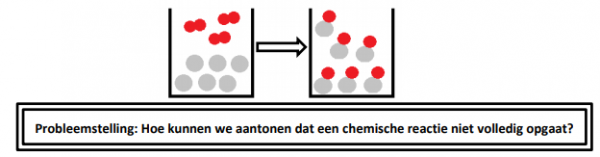
2. Opdrachten.
Ga nu naar: http://www.mhhe.com/physsci/chemistry/animations/chang_2e/limiting_reagent.swf
en zet je geluid uit. Dit is een simulatie waarbij je andere situaties als hierboven beschreven gaat tegenkomen. De reactie waar de simulatie het over heeft is:
NO + O2 –> NO2
Merk op dat in deze reactie de coëfficiënten niet zijn aangepast. Met andere woorden zijn de verhoudingen nog niet correct opdat de reactie volledig zou opgaan.
Onderaan zie je drie mogelijke verhoudingen die de simulatie kan afspelen. Probeer ze allemaal en verklaar hier welke de juiste verhouding is.![]()
Vul dan ook de coëfficiënten van de bovenstaande reactie aan.
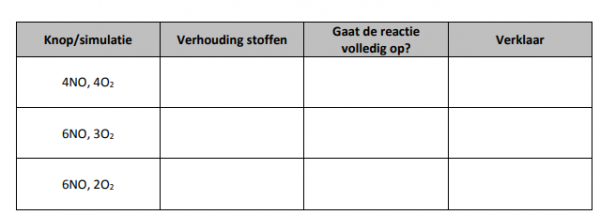
3. Begrippen.
Doorloop eerst simulatie 1, dan simulatie 3 en tot slot simulatie 2.
Simulatie 1:
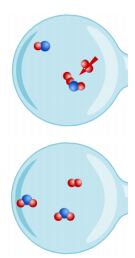
Wanneer het kraantje opengaat, worden de verschillende stoffen gemengd. In de linkse koker hebben we dan 2 NO moleculen en 2 O2 moleculen. Op een bepaald moment plakt een O2 molecule vast aan een NO molecule. Dit zie je door de rode pijl die tevoorschijn komt. Dit gebeurt niet zomaar. Zoals je kon zien duurde het even voordat deze aan elkaar plakten. Dit kan pas als beide moleculen hard genoeg tegen elkaar botsen en volgens een gunstige hoek. Dan spreken we over een effectieve of gunstige botsing.
We zien dat de moleculen nog steeds verder bewegen en tegen elkaar botsen. Het laatste NO molecule botste nu gunstig tegen het O2 molecule dat vastzat op het andere NO molecule van hierboven. Nu zijn er twee NO2 molecule gevormd.
*Vul nu dan eens de reactievergelijking in van de linkse koker:
NO + O2 –> NO2
Conclusie: Er blijft nog één …… molecule over. De ….. moleculen zijn helemaal weg gereageerd
Besluit: Daarom noemen we de stof NO de limiterende stof. De stof O2 is hier in overmaat.
Simulatie 3:
In de rechter koker zie je nu 3 NO moleculen en 1 O2 molecule. Bij een effectieve botsing (rode pijl) zie je dat er een O2 molecule vast hangt aan een NO molecule.
Bij verdere gunstige botsingen worden er 2 NO2 moleculen gevormd.
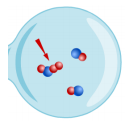
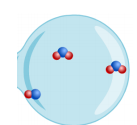
*Vul nu dan eens de reactievergelijking in van de linkse koker:
NO + O2 –> NO2
Conclusie: Er blijft nog één …… molecule over. De ….. moleculen zijn
helemaal weg gereageerd.
Besluit: Daarom noemen we de stof O2 de limiterende stof. De stof NO is hier
in overmaat.
Simulatie 2:
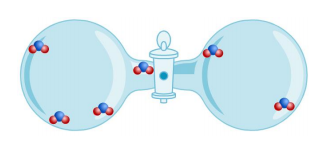
In beide kokers zijn alle gunstige botsingen gedaan.
*Vul nu dan eens de reactievergelijking in van de linkse koker:
NO + O2 –> NO2
Conclusie: Er blijven nog …… molecule over. De ……………….. moleculen zijn helemaal weg gereageerd.
Besluit: Er zijn in dit geval geen stoffen in overmaat. Er is dus geen limiterende stof meer. De stoffen waren in goede verhoudingen aanwezig.
Algemeen besluit:
Stoffen reageren met elkaar als ze in contact komen met elkaar. De deeltjes botsen als het waren tegen elkaar. Niet alle botsingen zorgen voor een reactie. Pas wanneer er een gunstige botsing is, onder de juiste omstandigheden, kunnen twee stoffen met elkaar reageren. Opdat alle reagentia zouden weg reageren, ter vorming van reactieproduct(en), moeten we juiste verhoudingen nemen
van de reagentia. Deze verhouding is af te lezen bij de coëfficiënten van de reactievergelijking. Wanneer er niet voldaan wordt aan die verhouding gaat de reactie niet volledig opgaan. Eén van de reagentia is dan de limiterende stof en de andere is dan in overmaat aanwezig.






