Modellen van een waterstofatoom
APP: http://phet.colorado.edu/nl/simulation/hydrogen-atom
Deel 1: Onderzoeksvraag
ONDERZOEKSVRAAG:
Wat zijn de verschillen tussen het klassiek atoommodel, het model van Bohr, Debroglie en Schrödinger?
MOGELIJKE HYPOTHESEN:
- Er is geen verschil.
- Het klassiek atoommodel heeft geen schillen de andere wel.
Deel2: Voorbereiden
BENODIGDHEDEN:
Materiaal:
- De simulatie
VOORKENNIS:
Te kennen begrippen:
- Atoommodel
- Proton
- Elektron
- Neutron
- Niveaus of schillen
OPSTELLING: foto beginpagina
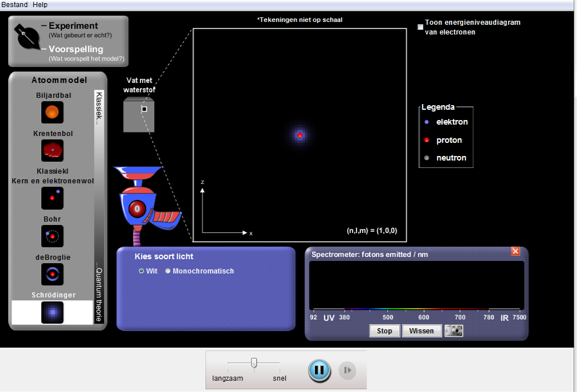
Deel3: Uitvoeren
Werkwijze: Werking van simulatie
- Kies een van de 4 atoommodellen aan de linkerkant.
- Zet de lichtbron aan.
- Kijk wat er gebeurt.
Uit te voeren simulaties (aanpassingen)
Je kan de lichtbron aanpassen door andere soorten straling op je atoommodel af te sturen.
Doel: Zien hoe de verschillende atoommodellen reageren op de lichtbron en op de verschillende golflengten van de andere soorten licht.
Enkele voorbeeldjes hieronder.
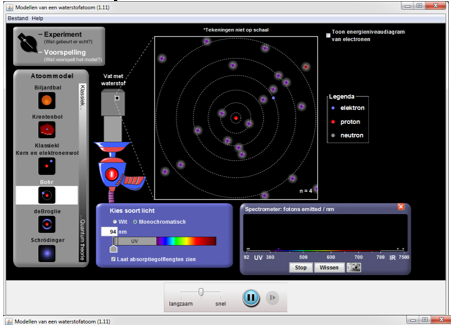
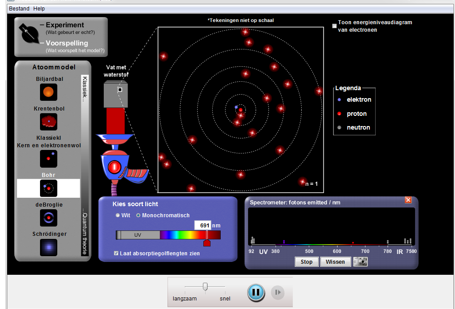
Deel4: Reflecteren
Besluit:
We zien dat bij sommige modellen het elektron of de schil verandert. Dit was een verandering van energieniveau.
De verandering van een energieniveau noemen we de aangeslagen toestand of de geëxciteerde toestand van een elektron.
Het verschil tussen deze atoommodellen komt neer op het feit dat in het klassiek atoommodel geen rekening is gehouden met de aangeslagen toestand van een elektron.
Deel5: Didactische verwerking
- Ga naar deze site: http://phet.colorado.edu/nl/simulation/hydrogen-atom
- Klik op “downloaden” of “speel nu af”.
- Als het programma zich opent klik dan eerst op voorstelling en kies een van de atoommodellen alvorens de lichtbron aan te zetten.
- Per atoommodel kijk je eerst hoe het reageert op de bron van wit licht.
- Klik daarna per atoommodel op monochromatisch. Vink “toon spectrometer” en “ laat absorptiegolflengten zien” aan.
- Kijk kan eens per atoommodel hoe deze gaat reageren op de verschillende soorten licht.
- Noteer je waarnemingen bij elk atoommodel en vergelijk.






