Hoofdstuk 11: Info met wolfram
Neutralisatiereacties
1, Verband pKa en Ka LINK
vb pKa
- -Neem het woord hierboven
- -Je krijgt dan de Ka-waarde
2, [H+] berekenen bij gegeven pH LINK
vb pH= 2.5
- -Neem de regel over, verander eventueel de waarde
- -Je krijgt dan de protonenconcentratie
3, pH berekenen bij gegeven [H+] concentratie LINK
vb 0.2 M pH
- -Neem de regel over, verander eventueel de waarde van de concentratie
- -Je krijgt dan de pH
4. pH berekenen bij gegeven [OH–] concentratie LINK
vb pH 0.2 M NaOH
- -Neem de regel over, verander eventueel de waarde van de concentratie
- -Je krijgt dan de pH
5. pOH berekenen bij gegeven [OH–] concentratie LINK
vb pOH 0.2 M NaOH
- -Neem de regel over, verander eventueel de waarde van de concentratie
- -Je krijgt dan de pH
6. , pOH berekenen bij gegeven pH LINK
vb pOH pH = 2
- -Neem de regel over, verander eventueel de waarde van de pH
- -Je krijgt dan de pOH
7. pH berekenen bij gegeven pOH LINK
vb pH pOH = 2
- -Neem de regel over, verander eventueel de waarde van de pOH
- -Je krijgt dan de pH
8. , pH berekenen bij gegeven Ka waarde en concentratie van het zuur LINK
vb 0,1 M Ka=4.9x10^-10
- -Neem de regel over, verander eventueel de waarde van de concentratie of Ka-waarde
- -Je krijgt dan de pH van deze zuuroplossing
9. pKa van zuren opzoeken LINK
vb pKa of CH3COOH
- -Neem de zin hierboven. Eventueel geef je een ander zuur aan
- -Je krijgt dan de pKa-waarde
10. pH van zwak zuren berekenen LINK
vb 1 M CH3COOH pH
- -Neem de zin hierboven. Eventueel geef je een ander zuur aan
- -Je krijgt dan de pH-waarde
11. pOH van zwak zuren berekenen LINK
vb 1 M CH3COOH pH
- -Neem de zin hierboven. Eventueel geef je een ander zuur/concentratie aan
- -Je krijgt dan de pOH-waarde
12. Protonenconcentratie van een oplossing zwak zuur LINK
vb 1 M benzoic acid [H+]
- -Neem de zin hierboven. Eventueel geef je een ander zuur/andere concentratie aan
- -Je krijgt dan de [H+]
13. Titratiecurve sterk zuur met sterke base met ingevoerde conc base, volume zuur en base LINK
vb titration curve acid concentration
- -Neem de zin hierboven. Eventueel geef je een andere waarde voor conc base en volumes zuur in te geven
- -Je krijgt dan de titratiecurve
14. Titratiecurve sterk zuur met sterke base met ingevoerde conc base, zuur en volume base LINK
vb titration curve volume acid
- -Neem de zin hierboven. Eventueel geef je een andere waarde voor conc base, zuur en volumes base in te geven
- -Je krijgt dan de titratiecurve
15. Titratiecurve sterk zuur met sterke base met ingevoerde conc base, zuur en volume zuur LINK
vb titration curve volume base
- -Neem de zin hierboven. Eventueel geef je een andere waarde voor conc base en volumes base en zuur in te geven
- -Je krijgt dan de titratiecurve
16. Titratiecurve sterk zuur met sterke base met ingevoerde conc zuur en volume zuur en base LINK
vb titration curve volume base
- -Neem de zin hierboven. Eventueel geef je een andere waarde voor conc zuur en volumes base en zuur in te geven
- -Je krijgt dan de titratiecurve
17. pH van zuur met gegeven concentratie in g/l LINK
vb HCN 2 g/l pH
- -Neem de zin hierboven. Eventueel geef je een andere waarde voor conc verbinding en soort zuur
- -Je krijgt dan de pH
18. Welke zuur-base indicatoren veranderen van kleur bij een bepaalde pH waarde LINK
vb indicators that change color at pH 3
- -Neem de zin hierboven. Eventueel geef je een andere pH waarde
- -Je krijgt dan de lijst van indicatoren die in kleur omslaan en bij welke waarde en hoe
19. Lijst van de zuur-base indicatoren LINK
pH indicators
- -Neem de zin hierboven.
- -Je krijgt dan de lijst van indicatoren die in kleur omslaan en bij welke waarde en hoe
20. Lijst van de zuur-base indicatoren geschikt bij een bepaalde pH waarde LINK
vb indicators for pH 9
- -Neem de zin hierboven. Eventueel verander je de pH waarde
- -Je krijgt dan de lijst van indicatoren die rond deze waarde van kleur omslaan
21. Maken van een verdunning uit een geconcentreerde zuuroplossing LINK
vb 4 M HCl preparation
- -Neem de zin hierboven. Eventueel verander je de concentratie of het zuur
- -Je krijgt dan aangeven hoeveel ml je dient te nemen van de geconcentreerde oplossing om de verdunde oplossing (1 liter) te maken
22. Maken van een verdunning uit een geconcentreerde ammoniakoplossing LINK
vb 4 M NH3 preparation
- -Neem de zin hierboven. Eventueel verander je de concentratie of het ammoniak
- -Je krijgt dan aangeven hoeveel ml je dient te nemen van de geconcentreerde oplossing om de verdunde oplossing (1 liter) te maken
23. Buffer pH met gekende pKa en concentraties buffercomponenten LINK
vb buffer
- -Neem de zin hierboven. Eventueel verander je de concentratie zuur en base + pKa
- -Je krijgt dan de pH waarde
24. pKa van buffer met pH waarde en concentraties buffercomponenten LINK
vb buffer
- -Neem de zin hierboven. Eventueel verander je de concentratie zuur en base + pH
- -Je krijgt dan de pKa
25. Buffer K2PO4/K2HPO4: concentraties aan te passen.: aqion – Online pH Calculator
Gegeven is een 0,03 molaire fosfaatbuffer die bestaat uit 4 mmol/l KH2PO4 en 26 mmol/l K2HPO4. Wat is de pH van deze
bufferoplossing bij 25?

26. Buffer K2PO4/K2HPO4: concentraties aan te passen.: aqion – Online pH Calculator
Effect toegevoegde base
Gegeven is een 0,03 molaire fosfaatbuffer die bestaat uit 4 mmol/l KH2PO4 en 26 mmol/l K2HPO4. Wat is het effect van toevoeging van 1,0 mmol/l NaOH?

27. Buffer K2PO4/K2HPO4: concentraties aan te passen.: aqion – Online pH Calculator
Effect van toevoeging sterke base (invloed hoeveelheid)
Gegeven is een 0,03 molaire fosfaatbuffer die bestaat uit 4 mmol/l KH2PO4 en 26 mmol/l K2HPO4. Wat is het effect van toevoeging van 10,0 mmol/l NaOH?

28. Buffer K2PO4/K2HPO4: concentraties aan te passen.: aqion – Online pH Calculator
Effect van toevoeging sterk zuur
Gegeven is een 0,03 molaire fosfaatbuffer die bestaat uit 4 mmol/l KH2PO4 en 26 mmol/l K2HPO4. Wat is het effect van toevoeging van 1,0 mmol/l HCl?
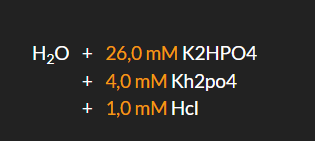
29. Buffer K2PO4/K2HPO4: concentraties aan te passen.: aqion – Online pH Calculator
Effect van toevoeging sterk zuur (invloed hoeveelheid)
Gegeven is een 0,03 molaire fosfaatbuffer die bestaat uit 4 mmol/l KH2PO4 en 26 mmol/l K2HPO4. Wat is het effect van toevoeging van 10,0 mmol/l HCl?

30. Buffer NH3/NH4Cl: concentraties aan te passen.: aqion – Online pH Calculator
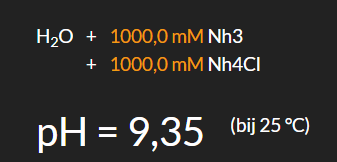
31. pH berekeningen van pH-zouten met Aqion.onl. De zuurrest en de concentraties zijn aan te passen.






